Ученые создали комплексную синтетическую вакцину на основе молекул ДНК
Работая над исследованием, опубликованным недавно в журнале Nano Letters, иммунолог Юнг Чанг (Yung Chang) из Института Биопроектирования объединил усилия со своими коллегами, в числе которых упоминается известный специалист по ДНК-нанотехнологиям Хао Ян (Hao Yan), для того чтобы синтезировать первый в мире вакцинный комплекс, который можно безопасно и эффективно доставлять к нужным участкам посредством его размещения на самоорганизующихся, объемных ДНК-наноструктурах.
«Когда Хао предложил рассматривать ДНК не как генетический материал, а как рабочую платформу, у меня возникла мысль применить этот подход в иммунологии», - говорит Чанг, адъюнкт-профессор из Школы Бионаук (the School of Life Sciences) и исследователь из Центра Инфекционных Заболеваний и Вакцин при Институте Биопроектирования. «Это должно было дать нам отличную возможность воспользоваться ДНК-носителями для создания синтетической вакцины».
«Главный вопрос звучал так: безопасно ли это? Мы хотели воспроизвести группу молекул, которые могли бы вызвать безопасный и мощный иммунный ответ в организме. Поскольку команда под руководством Хао в течение последних нескольких лет занималась конструированием различных ДНК-наноструктур, мы начали сотрудничать с целью отыскать потенциальные сферы применения таких структур в области медицины».
Уникальность предложенного учеными из Аризоны метода заключается в том, что носителем антигена являвляется молекула ДНК
В мультидисциплинарную исследовательскую группу также входили: аспирант-биохимик из Университета в Аризоне, первый автор работы Сяовей Лиу (Xiaowei Liu), профессор Янг Су (Yang Xu), преподаватель биохимии Ян Лиу (Yan Liu), студент из Школы Бионаук Крейг Клиффорд (Craig Clifford) и Тао Ю (Tao Yu), аспирант из Сычуаньского Университета в Китае.
Чанг подчеркивает, что повсеместное внедрение вакцинации населения привело к одному из самых существенных триумфов общественной медицины. Искусство создания вакцин полагается на генную инженерию в плане конструирования вирусоподобных частиц из протеинов, стимулирующих иммунную систему. Такие частицы схожи по своей структуре с настоящими вирусами, но не содержат при этом опасных генетических компонентов, вызывающих заболевания.
Важное достоинство ДНК-нанотехнологии, в рамках которой биомолекуле можно придавать двух- или трехмерную форму, заключается в возможности очень точными методами создавать молекулы, способные выполнять функции, характерные для естественных молекул в организме.
«Мы экспериментировали с разными размерами и формами ДНК-наноструктур и добавляли к ним биомолекулы, чтобы узнать, как на них отреагирует организм», - поясняет Ян, директор факультета химии и биохимии, исследователь из Центра Биофизики Одиночных Молекул (Center for Single Molecule Biophysics) при Институте Биопроектирования. Благодаря подходу, который ученые называют «биомимикрией», вакцинные комплексы, протестированные ими, приближаются по своим размерам и формам к природным вирусным частицам.
Чтобы показать перспективность своей концепции, исследователи закрепили имунностимулирующий протеин стрептавидин (STV), а также усиливающий иммунный ответ препарат CpG олигодеоксинуклетид на отдельных пирамидальных разветвленных ДНК-структурах, что должно было позволить им получить в итоге синтетический вакцинный комплекс.
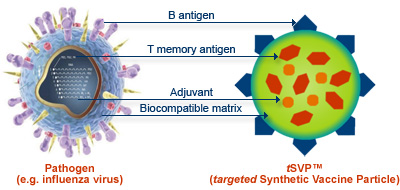
Схематичное сравнение структур патогенного вируса гриппа (слева) и частицы синтетической вакцины (справа)
В первую очередь научной группе нужно было доказать, что клетки-«мишени» способны поглотить наноструктуры. Присоединив светоизлучающую молекулу-метку к наноструктуре, ученые убедились в том, что наноструктура находит подобающее ей место в клетке и остается стабильной на протяжении нескольких часов – достаточно долго, для того чтобы вызвать иммунный ответ.
Затем, в опытах на мышах, ученые отрабатывали доставку вакцинного «груза» к клеткам, которые являются первыми звеньями в цепи иммунной реакции организма, координирующими взаимодействие между разными компонетнтами вроде антиген-представляющих клеток, включая макрофаги, дендритные клетки и B-клетки. После того как наноструктуры проникают в клетку, они «анализируются» и «отображаются» на клеточной поверхности, так чтобы их распознали T-клетки, белые гемоциты (клетки крови), играющие центральную роль в процессе запуска защитной реакции организма. T-клетки, в свою очередь, помогают B-клеткам вырабатывать антитела против чужеродных антигенов.
Чтобы надежно протестировать все варианты, исследователи вводили в клетки как полный вакцинный комплекс, так и отдельно STV-антиген, а также STV-антиген, смешанный с CpG-усилителем.
По прошествии 70-дневного периода ученые обнаружили, что мыши, иммунизированные полным вакцинным комплексом, продемонстрировали иммунный ответ, в 9 раз более сильный по сравнению с вызванным смесью CpG c STV. Наиболее заметную реакцию инициировала структура именно тетраэдрической (пирамидальной) формы. Однако иммунный ответ на вакцинный комплекс признан не только специфическим (то есть реакцией организма на конкретный антиген, использовавшийся экспериментаторами) и эффективным, но и безопасным, что подтверждается отсутствием иммунной реакции на вводившиеся в клетки «пустые» ДНК (не несущие биомолекулы).
«Мы были весьма довольны», - говорит Чанг. «Так замечательно видеть результаты, которые мы сами предсказали. Такое не часто случается в биологии».
Будущее фармакологической отрасли за таргетированными лекарственными препаратами
Теперь команда исследователей размышляет над возможными перспективами нового метода стимулирования особых иммунных клеток с целью вызова реакции за счет использования ДНК-платформы. На базе новой технологии можно создавать вакцины, состоящие из нескольких действующих препаратов, а также изменять цели для регуляции иммунного ответа.
Кроме того, новая технология обладает потенциалом для разработки новых способов целевой терапии, в частности, производства «таргетированных» лекарств, которые доставляются в строго отведенные участки организма и потому не дают опасные побочные эффекты.
Наконец, несмотря на то что ДНК-направление еще только развивается, научная работа исследователей из Аризоны имеет серьезное прикладное значение для медицины, электроники и других областей.
Чанг и Ян признают, что еще многое предстоит изучить и оптимизировать в представленном ими методе вакцинации, но ценность открытия неоспорима. «Имея на руках практическое подтверждение нашей концепции, мы теперь можем производить синтетические вакцины с неограниченным числом антигенов», - подводит итог Чанг.
Финансовая поддержка в проведении научной работы была оказана Министерством Обороны США и Национальными Институтами Здоровья.
Комментарии: